コロナ患者に新型インフルエンザ治療薬も投与すると表明した加藤厚労相(AFP=時事通信フォト)
新型コロナウイルスによる肺炎は、日本でも感染者数が800人を超え、感染経路が不明の感染者が次々と出現するなど、大規模流行のリスクが深刻さを増している。一刻も早いワクチンや抗ウイルス薬といった“特効薬”の開発が待たれるが、現状まったく目途は立っていない。ニッセイ基礎研究所・主席研究員の篠原拓也氏が、医薬品の開発がなかなか進まない理由について解説する。
* * *
中国湖北省武漢市で発生した新型コロナウイルスによる感染症は、致死率はそれほど高くないといわれている。しかし、感染防止のためのワクチンや、患者に投与する抗ウイルス薬はまだ出てきておらず、感染拡大を抑制できない状態が続いている。
日本でも国内・海外の多くの医薬品メーカーが、ワクチンや抗ウイルス薬の開発に取り組んでいるとされるが、医薬品が世の中に出るまでには、相当な時間がかかるとみられている。
感染症に限らず、がんや認知症など、さまざまな病気に対して、医薬品メーカーは、新薬開発の努力を重ねている。しかし、新薬開発には多くの困難が伴い、簡単には実用化に至らない。本稿では、その理由について見ていくこととしたい。
◆新薬開発にかかる多くの時間と費用
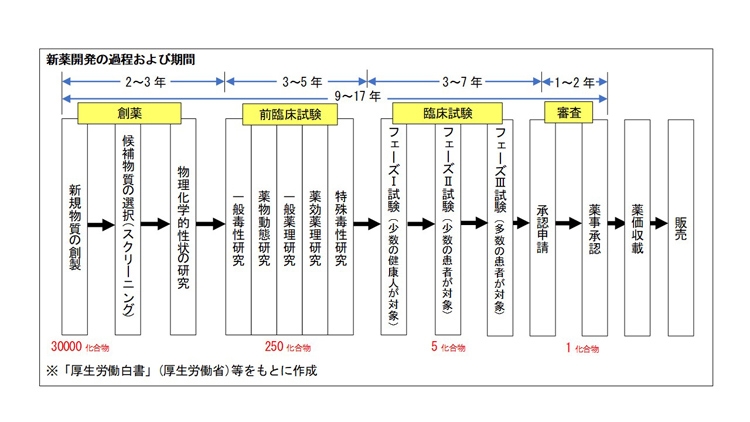
一般的に、1つの新薬の開発には9~17年の時間を要し、300億円以上もの費用が必要となる。新薬開発は、創薬、前臨床試験、臨床試験、審査を経て、薬事承認された後に薬価収載を経て販売に至る。販売して実用化された後は、モニタリングが行われる。
新薬開発は、多くの化合物の候補をふるいにかけていく作業といえる。そのために、医薬品候補となる化合物の種類をどれだけ持っているかが、医薬品メーカーの基礎体力となる。典型的には、創薬段階で、医薬品候補となる3万もの化合物から、前臨床試験までに250程度にまで絞られ、臨床試験に入るのは5つ程度となる。
この5つ程度の候補について、フェーズI~IIIの臨床試験を通じて、有効性や副作用の有無などをテストする。
まずフェーズIは、少人数の健康な人に投与して、副作用となる毒性の有無や程度を調べる。ここで特に問題がなければ、フェーズIIに進み、少人数の患者に投与して、治療効果や安全性を確認する。あわせて、薬効の様子や適応症の検討、用量の設定なども行われる。
これをパスすると、最後のフェーズIIIに進み、多数の患者に投与して、有効性や安全性について確認する。確認にあたって、医薬品候補と色、形などは同じだが薬効のない偽薬(プラセボ)を用いて、薬を飲んだことの心理的効果が有効性に影響しないよう、慎重にテストする。
このフェーズIIIは、数千人規模の患者を対象とする本格的な臨床試験となることもあり、ここで研究開発費の約半分が費やされるといわれる。もしフェーズIIIを実施した後に化合物が1つも残らなければ開発中止となり、新薬メーカーにとって巨額の費用損失となる。また、希少な病気に対する新薬開発では、臨床試験に必要な患者をどのように確保するかが大きな課題となる。
新薬開発で行われる幾多の臨床試験